Este método te será muy útil sí sabes manejarlo bien, quizá se te haga algo confuso pero repásalo hasta que te quede claro, muchos compañeros prefieren este método al algebraico, aunque también en éste necesitas un poco de matemáticas, para este método necesitarás saber el número de oxidación del elemento así que, te recomiendo tener una tabla periódica a la mano.
Primero hay que saber las REGLAS MÉTODO REDOX:
1-La suma de sus cargas + y - en la formula debe ser = a cero.
2-El 'H' tiene como valencia 1 excepto en hidruros -1.
3-El 'O' tiene valencia -2 excepto en peróxidos -1.
4-Todo elemento que no se a combinado su valencia será cero.
5-Todos los metales del grupo I y II tienen valencia +1 y +2.
Con esto ya visto, lo siguiente es verificar que la suma de las cargas + y - de cada molécula den cero.
 Para hacer esto tu debes multiplicar el subíndice de elemento por su número de oxidación, y sumar el resultado con el resto de los elementos, tomando en cuenta los signos, mira el siguiente ejemplo:
Para hacer esto tu debes multiplicar el subíndice de elemento por su número de oxidación, y sumar el resultado con el resto de los elementos, tomando en cuenta los signos, mira el siguiente ejemplo:
 Como puedes ver, yo les señalé el número de oxidación a cada elemento como superíndice, si tu multiplicas el número de oxidación por el subíndice de cada elemento, obtendrás esto, +1+5-6 lo siguiente es sumarlos, y te da cero. Esto se tiene que hacer con todas las moléculas de la ecuación, tanto en los reactivos como en los productos.
Como puedes ver, yo les señalé el número de oxidación a cada elemento como superíndice, si tu multiplicas el número de oxidación por el subíndice de cada elemento, obtendrás esto, +1+5-6 lo siguiente es sumarlos, y te da cero. Esto se tiene que hacer con todas las moléculas de la ecuación, tanto en los reactivos como en los productos.Ten mucho cuidado al colocar los números de oxidación, ya que puedes encontrarte con un PERÓXIDO, te mostraré qué es un peróxido:

 Si tu revisas en tu tabla periódica el número de oxidación del oxígeno es -2 pero cuando es un PERÓXIDO su número de oxidación será -1, tu te darás cuenta cuando es un peróxido porque encontrarás que el 'O' tendrá un dos como subíndice y el metal que esté a su lado también lo tendrá.
Si tu revisas en tu tabla periódica el número de oxidación del oxígeno es -2 pero cuando es un PERÓXIDO su número de oxidación será -1, tu te darás cuenta cuando es un peróxido porque encontrarás que el 'O' tendrá un dos como subíndice y el metal que esté a su lado también lo tendrá.Muy bien, una vez teniendo en cuenta todos estos conceptos comencemos a balancear nuestra ecuación.
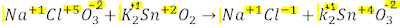 Es una ecuación grande, y he señalado con amarillo los números de oxidación de cada elemento, y no olvides nuestro objetivo, encontrar los coeficiente faltantes para balancear la ecuación.
Es una ecuación grande, y he señalado con amarillo los números de oxidación de cada elemento, y no olvides nuestro objetivo, encontrar los coeficiente faltantes para balancear la ecuación.Yo ya he verificado que la suma de las cargas den cero, pero de igual forma puedes hacerlo tu también.
El siguiente paso es ver, qué elementos cambian de número de oxidacion del lado de los productos, que en este caso serían el 'Sn' y el 'Cl', ahora te mostraré una regla que nos será muy útil.
 Esta regla nos servirá para saber que sucede con el elemento, si se reduce o se oxida, por ejemplo el 'Sn' en los reactivos tiene como número de oxidación el +2 y en los productos el +4 si tu te posicionas en la regla anterior en el +2 y pasas hasta el +4 notarás que el elemento se oxida y pierde 2 electrones. Tu debes de colocar tus elementos así:
Esta regla nos servirá para saber que sucede con el elemento, si se reduce o se oxida, por ejemplo el 'Sn' en los reactivos tiene como número de oxidación el +2 y en los productos el +4 si tu te posicionas en la regla anterior en el +2 y pasas hasta el +4 notarás que el elemento se oxida y pierde 2 electrones. Tu debes de colocar tus elementos así: Debes de colocar el elemento con su número de oxidación en los reactivos, los electrones que ganaron o perdieron y el elemento con su número de oxidación en los productos, en en caso del 'Cl' se reduce y gana 6 electrones, ya que pasa del +5 al -1.
Debes de colocar el elemento con su número de oxidación en los reactivos, los electrones que ganaron o perdieron y el elemento con su número de oxidación en los productos, en en caso del 'Cl' se reduce y gana 6 electrones, ya que pasa del +5 al -1.Lo siguiente que hay que hacer es hacer una multiplicación cruzada:
 El número de electrones que gana el 'Cl' se multiplica por toda la ecuación del 'Sn' y el número de electrones que pierde el 'Sn' se multiplican por toda la ecuación del 'Cl', quedándonos así:
El número de electrones que gana el 'Cl' se multiplica por toda la ecuación del 'Sn' y el número de electrones que pierde el 'Sn' se multiplican por toda la ecuación del 'Cl', quedándonos así: En toda ecuación deben de quedarte iguales los números de los electrones que se ganan o se pierden para poder eliminarlos, en este caso eliminamos los '12' ya que son iguales y tiene signos diferentes, lo siguiente es colocar todo en una misma ecuación lineal, solo súmale el 'Cl' al 'Sn' así:
En toda ecuación deben de quedarte iguales los números de los electrones que se ganan o se pierden para poder eliminarlos, en este caso eliminamos los '12' ya que son iguales y tiene signos diferentes, lo siguiente es colocar todo en una misma ecuación lineal, solo súmale el 'Cl' al 'Sn' así: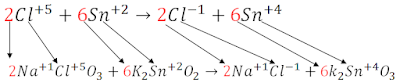 Como puedes observar en la imagen anterior, coloco los coeficientes en la ecuación original, y como lo hago..? mira bien en qué formula se encuentra el 'Cl' y le colocas el coeficiente al principio, lo mismo para el 'Sn'.
Como puedes observar en la imagen anterior, coloco los coeficientes en la ecuación original, y como lo hago..? mira bien en qué formula se encuentra el 'Cl' y le colocas el coeficiente al principio, lo mismo para el 'Sn'.Ahora lo que faltaría es verificar si realmente nuestra ecuación quedó Balanceada, de la misma forma que en los métodos anteriores, multiplica el coeficiente por el subíndice de cada elemento, y debe de darte el mismo resultado tanto en los reactivos como en los productos.






Felicidades diana..!!
ResponderEliminartu blog te esta quedando muy bien esta super entendible, no necesite mas que leerlo una vez (:
sigue asii ;)
TE FELICITO POR TU INTERÉS DE AYUDAR A LOS DEMÁS. SOLO TIENES QUE CORREGIR LA IMAGEN DONDE HAY QUE HACER LA MULTIPLICACIÓM CRUZADA YA QUE ASÍ COMO LO EXPONES LOS RESULTADOS DE LAS MULTIPLICACIONES SON 6 X 6 ES 36 Y 2X2 ES 4 Y NO DA EL RESULTADO QUE MENCIONAS ABAJO
ResponderEliminarHola antes que nada muchas gracias por tu interés espero realmente sea de ayuda, y sobre la imagen creo que no me di a entender, verás la flecha no indica que el 6 multiplica al 6 y el 2 al 2, si no que ese 6 pasará multiplicando a toda la primera ecuación, y ese 2 pasará multiplicando a toda la segunda ecuación, es por eso que el resultado es 12. GRACIAS... y SUERTE!!
EliminarHola gracias por la informacion me sirbe de mucho les debo una yo penes k no la podria aser gracias espero que como ami a muchos les sirva esta pagina con la informacion k biene
ResponderEliminarlos quiere ???????????????
muchas grasias
ResponderEliminar¡Eres un Crack explicando, Felicidades! ;D
ResponderEliminarEres un Crack explicando, Felicidades :D
ResponderEliminaruuuuuf Q Bn Explicas Gracias Ya Entiendo Un Poco Mas !!!!
ResponderEliminarMuchas gracias por tu blog y por la buenísima explicación, ¡me sirves de mucha ayuda!
ResponderEliminarSigue así.